TS. Nguyễn Hữu Nghị
1. Đặt vấn đề
Dịch viêm đường hô hấp cấp do chủng mới của virus corona (SARS-CoV-2) gây ra (covid-19) phát nguồn từ Vũ Hán, Trung Quốc tháng 12 năm 2019. Cho đến nay, dịch đã lây lan trên khắp thế giới với 193 triệu ca mắc và hơn 4 triệu người chết (WHO). Coronavirus là nhóm các loài virus thuộc phân họ Coronavirinae trong họ Coronaviridae, của bộ Nidovirales. Coronavirus là virus có hệ gen ARN dương sợi đơn kèm nucleocapsid đối xứng xoắn ốc. Bộ gen của Coronavirus lớn khoảng từ 26 - 32 kilo base. Hình ảnh dưới kính hiển vi điện tử của chúng có một vành tạo bởi các protein bề mặt giống như vương miện, bởi vậy chúng có tên gọi Coronavirus.
Hiện nay, trên thế giới đang tập trung vào phát triển các loại vaccine cũng như thuốc giúp phòng và điều trị đại dịch Covid-19. Một số vaccine đã được sử dụng trong trường hợp khẩn cấp như Astrazeneca, Pfizer, Moderna, Sputnix…Tuy nhiên, chưa có thuốc đặc trị dịch Covid-19, việc thử nghiệm các loại thuốc kháng virus đang được tiến hành và chưa có kết quả khả quan. Chỉ một số thuốc được FDA cấp phép sử dụng trong trường hợp khẩn cấp. Trong bài tổng quan này, chúng tôi sẽ tìm hiểu về cấu trúc hệ gene, cơ chế quá trình xâm nhập, nhân lên và phát tán của virus SARS-CoV-2 trong tế bào. Quá trình nghiên cứu và phát triển, những hạn chế và định hướng các liệu pháp phòng và điều trị Covid-19 cũng sẽ được thảo luận để xây dựng các định hướng tìm và phát triển các loại thuốc để phòng và điều trị Covid-19.
2. Cấu trúc hệ gene của virus SARS-CoV-2
SARS-CoV-2 có 79% trình tự gene tương đồng với SARS-CoV và 50% tương đồng với MERS-CoV. Cấu trúc hệ gene của SARS-CoV-2 tương đồng với các betacoronavirus khác. Với 6 khung đọc mở chức năng (ORFs) được sắp xếp theo trình tự từ đầu 5’ đến 3’. SARS-CoV-2 có 4 protein cấu trúc chính bao gồm protein spike (S), protein màng (M), protein vỏ (E) và nucleocapsid (N). Các protein này nằm ở đầu 3’ của bộ gen virus. Hầu hết các protein được mã hóa bởi SARS-CoV-2 có độ dài tương tự các protein được mã hóa bởi các SARS-CoV khác. Trong 4 gene cấu trúc, SARS-CoV-2 có trên 90% các amino acid tương đồng với SARS-CoV ngoại trừ gene S. Gene sao chép chiếm 2/3 bộ gene ở đầu 5’ và mã hóa protein liên hợp (pp1ab) và được phân cắt thành 16 protein không cấu trúc tham gia vào quá trình phiên mã và nhân lên của virus. Hầu hết các protein không cấu trúc trong SARS-CoV-2 có trên 85% trình tự amino acid tương tự với SARS-CoV. Sử dụng phương pháp giải trình tự các miền sao chép trong pp1ab bao gồm 3-Chymotrypsin -like protease (3CLpro), nidovirus RNA-dependent RNA polymerase (RdRp)-associated nucleotidyltransperase (NiRAN), RdRp, Zinc-binding domain (ZBD) và Helicase 1 (HEL1), nhóm nghiên cưu phân loại virus quốc tế đã so sánh và kết luận SARS-CoV-2 thuộc các loài trong nhóm SARS-CoV.[1]
Protein spike S của SARS-CoV-2 gồm 1273 amino acid, dài hơn của SARS-CoV (1255 amino acid) với 76,7-77,0% tương đồng các amino acid với SARS-CoV ở Cầy Hương và người, 75-97,7% với coronavirus ở Dơi và 90,7-92,6% ở coronavirus ở Tê Tê. Trong vùng liên kết thụ thể (RBD) của protein S, sự tương đồng về amino acid giữa SARS-CoV-2 và SARS-CoV là 73%. Một đặc điểm di truyền đặc biệt khác của SARS-CoV-2 là có 4 amino acid (PRRA) đươc chèn vào vùng nối giữa tiểu phần S1 và S2 trong cấu trúc của protein S.[2]
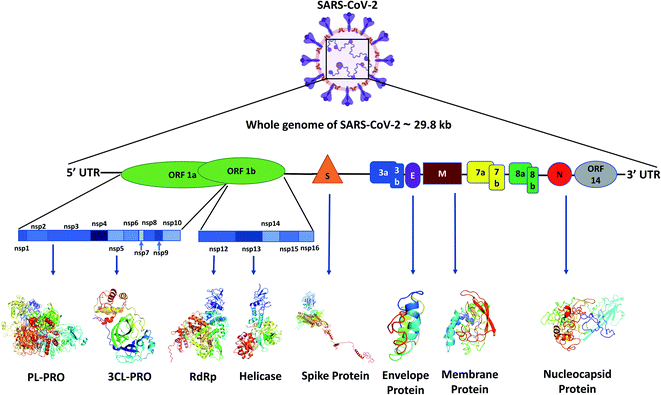
Hình 1. Cấu trúc hệ gene và các protein được mã hóa trong SARS-CoV-2[3]
3. Cơ chế xâm nhập nhân lên và phát tán của SARS-CoV-2 trong tế bào người
SARS-CoV-2 xâm nhập vào tế bào người thông qua cùng thụ thể với SARS-CoV khác là enzyme chuyển angiotensin 2 (ACE2). Ngoài các ACE2 của người, SARS-CoV-2 cũng có khả năng nhận diện các ACE2 của các loài động vật như lợn, dơi, thỏ, chó, mèo…Điều này cho thấy, SARS-CoV-2 có thể xâm nhâp và lây nhiễm ở nhiều loại vật chủ. Protein S trong SARS-CoV-2 được cấu tạo bởi 2 tiểu phần chức năng là S1 và S2. S1 có chức năng liên kết với thụ thể ACE2 và S2 có vai trò dung hợp virus với màng tế bào. Tiểu phần S1 được chia thành hai miền chức năng gồm miền đầu cuối N và miền đầu cuối C. Miền đầu cuối C trong tiểu phần S1 là vùng liên kết với thụ thể (RBD) có vai trò quan trọng trong việc xâm nhập của virus vào tế bào và là mục tiêu của các kháng thể trung hòa. [4]
Tương tự các coronavirus khác, SARS-CoV-2 cần quá trình phân giải protein S để kích hoạt quá trình xâm nhập vào nội bào. Kết quả nghiên cứu chỉ ra rằng, enzyme protease của vật chủ tham gia vào quá trình phân cắt protein S và kích hoạt sự xâm nhập của SARS-CoV-2. Các enzyme này bao gồm enzyme protease xuyên màng serine 2 (TMPRSS2), catheepsin L, và furin. Dữ liệu giải trình tự RNA đơn bào cho thấy có sự đồng biểu hiện của TMPRSS2 với ACE2 trong tế bào biểu mô mũi, phổi, các phế quản. Một số xét nghiệm xâm nhập pseudovirus SARS-CoV-2 cho thấy TMPRSS2, cathepsin L cùng với furin tham gia vào quá trình kích hoạt sự xâm nhập của virus vào trong tế bào.[5]
Sau khi xâm nhập vào tế bào, RNA của SARS-CoV-2 sẽ được giải phóng và dịch mã thành hai khung đọc mở ORF1a và ORF1b. Các protein liên hợp pp1a và pp1ab sẽ được dịch mã cùng hoặc sau đó để tạo thành các protein phi cấu trúc đơn (nsps) là hỗn hợp cho quá trình dịch mã và sao chép của virus. Cùng với sự tạo thành các protein phi cấu trúc là sự phát sinh các bào quan sao chép của virus bao gồm các túi màng kép đặc trưng (DMV), các màng phức tạp (CM) và các quả cầu màng kép mở nhỏ (DMS) để tạo ra môi trường bảo vệ cho quá trình sao chép RNA và quá trình phiên mã của mRNA. Các protein cấu trúc sau đó di chuyển vào màng lưới nội chất (ER) và chuyển qua ngăn trung gian ER-Golgi (ERGIC). Ở đó, bộ gen của virut được bao bọc bởi protein N thành các Nucleocapsid. Protein M phối hợp với protein E tích hợp vào màng của ERGIC thành lớp vỏ virus gắn bọc lấy Nucleocapsid tạo ra các hạt giống virus (VLP). Sau đó protein S gắn vào lớp màng của VLP thành các hạt virion trưởng thành. Sau khi lắp ráp, virion được vận chuyển đến bề mặt tế bào trong các túi và được giải phóng bởi exocytosis.[6] Hình 2.

Hình 2. Quá trình xâm nhập, nhân lên và phát tán của virus SARS-CoV-2 trong tế bào[6]
4. Một số liệu pháp điều trị covid-19
4.1. Phương pháp ngăn virus xâm nhập vào trong tế bào
SARS-CoV-2 xâm nhập vào tế bào thông qua thụ thể ACE2 và các protease là chất kích hoạt quá trình xâm nhập. Sau đó, màng tế bào người và màng virus sẽ hợp nhất để virus tiến vào trong tế bào người. Do đó việc phát triển các loại thuốc tác động vào quá trình xâm nhập này có thể là liệu pháp tiềm năng để phòng ngừa covid-19. Umifenovir (arbidol) là một loại thuốc được phê duyệt ở Nga và Trung quốc để điều trị cúm và các bệnh nhiễm trùng đường hô hấp khác. Thuốc có thể tác động đến quá trình tương tác giữa protein S trên màng tế bào virus với ACE2 để ức chế quá trình dung hợp màng. Tác dụng này đã được chứng minh bằng các nghiên cứu in vitro và các nghiên cứu lâm sàng hiện nay cũng cho thấy kết quả khả quan hơn so với lopinavir và ritonavir.[7],[8] Tuy nhiên một số kết quả nghiên cứu lâm sàng lại chỉ ra rằng, thuốc này không thể hiện tác dụng tiêu diệt virus đối với các bệnh nhân nhiễm covid-19 ở mức độ nhẹ đến trung bình.[9],[10]
Camostat mesylate là một loại thuốc được sử dụng ở Nhật Bản để điềm trị bệnh viêm tụy và viêm thực quản do trào ngược sau phẫu thuật. Các nghiên cứu trước đây trên mô hình động vật cho thấy, thuốc có khả năng ngăn cản sự xâm nhập của SARS-CoV vào tế bào thông qua tác dụng ức chế TMPRSS2, enzyme tham gia vào quá trình kích hoạt tương tác giữa protein S của virus với ACE2 trên tế bào vật chủ. Kết quả nghiên cứu gần đây cho thấy, camostat mesylate có khả năng ngăn chặn sự xâm nhập của SARS-CoV-2 vào tế bào phổi người. Mặc dù các kết quả lâm sàng đối với loại thuốc này chưa đầy đủ, tuy nhiên đây cũng là một liệu pháp rất tiềm năng để phòng và điều trị covid-19.[5]
Chloroquine và hydroxychloroquine là 2 loại thuốc cũng được thử nghiệm để điều trị covid-19. Hai thuốc này đã được ứng dụng trong điều trị sốt rét. Tác dụng của thuốc là chúng có khả năng ức chế quá trình glycosyl hóa các thụ thể và do đó tác động đến quá trình gắn thụ thể với protein của virus. Hiện nay chưa có đủ các dữ liệu khoa học thống nhất về hiệu quả của hai loại thuốc này. Một số kết quả trên in vitro cho thấy tác dụng kháng Covid-19 nhưng các kết quả lâm sàng chưa cung cấp đủ bằng chứng về tác dụng.[11],[12] Gần đây kết quả của hai nghiên cứu lâm sàng cho thấy không có sự khác biệt về tỷ lệ bệnh nhân Covid-19 tử vong ở nhóm được sử dụng chloroquine hoặc hydroxychloroquine so với nhóm không sử dụng. Mặt khác, thuốc còn gây ra một số tác dụng phụ như gây rối loạn nhịp tim.[13],[14] Do hiệu quả lâm sàng thấp kèm theo tác dụng phụ không mong muốn nên FDA đã rút lại đề xuất sử dụng 2 loại thuốc này trong trường hợp khẩn cấp. Một hướng điều trị có thể xem xét đó là tìm các hoạt chất có khả năng khóa quá trình liên kết giữa protein S với ACE2 bằng việc sử dụng các ACE2 tái tổ hợp để cạnh tranh liên kết với protein S của virus, hoặc sử dụng các kháng thể đơn dòng hay các chất ức chế quá trình xâm nhập của protein S.[15] Tuy nhiên việc đánh giá hiệu quả của các liệu pháp này cần được nghiên cứu nhiều hơn cả tiền lâm sàng và trên lâm sàng.[1]
4.2. Phương pháp ngăn ngừa sự nhân lên của virus
Nhiều loại thuốc đã được sử dụng để điều trị SARS-CoV-2 thông qua cơ chế ức chế quá trình nhân lên của virus như remdesivir, favilavir, ribavirin, lopinavir và ritonavir. Trong khi lopinavir và ritonavir ức chế enzyme 3C-like protease (3CLpro), ba loại còn lại đều nhằm ức chế RNA-dependent RNA polymerase (RdRp). Remdesivir đã được nghiên cứu và chứng minh tác dụng chống lại SARS-CoV-2 trên in vitro và in vivo.[11],[16] Kết quả lâm sàng chỉ ra nhu cầu oxy của bệnh nhân covid-19 sử dụng thuốc remdesivir thấp hơn bệnh nhân không sử dụng thuốc.[17] Ngoài ra thuốc cũng cho kết quả rút ngắn thời gian hồi phục của bệnh nhân so với nhóm đối chứng dùng giả dược.[18] Do đó, thuốc remdesivir được FDA và liên minh châu Âu chấp thuận để sử dụng trong điều trị covid-19 mặc dù một số thử nghiệm lâm sàng giai đoạn III với thuốc này vẫn đang được tiến hành để đánh giá tính an toàn và hiệu quả của thuốc.
Favilavir là một loại thuốc kháng virus được nghiên cứu và sử dụng tại Nhật bản để điều trị bệnh cúm influenza cũng được sử dụng để điều trị covid-19 tại Trung Quốc, Nga và Ấn Độ. Các nghiên cứu lâm sàng ở Trung Quốc và Nhật Bản cho thấy hiệu quả về mặt rút ngắn thời gian phục hồi của bệnh nhân covid-19 ở cả bệnh nhân nặng và bệnh nhân nhẹ.[19] Tuy nhiên các nghiên cứu lâm sàng này thực hiện ở quy mô nhỏ do đó cần tiếp tục các thử nghiệm lâm sàng ở dung lượng mẫu lớn hơn để đánh giá hiệu quả của thuốc. Lopinavir và ritonavir là hai loại thuốc đã được chứng minh có tác dụng với SARS-CoV và MERS-CoV. Tuy nhiên kết quả thử nghiệm lâm sàng với các bệnh nhân Covid-19 tại Anh đã không cho kết quả tốt và chính phủ Anh đã kết thúc quá trình thử nghiệm hai loại thuốc này để điều trị Covid-19.[20]
Mới đây, hãng dược phẩm Merck (Mỹ) và công ty Ridgeback Biotherapeutics (Đức) vừa thử nghiệm thuốc uống Molnupiravir để điều trị Covid-19. Kết quả thử nghiệm lâm sàng giai đoạn III và đang hứa hẹn sẽ là loại thuốc có hiệu quả cao. Chính phủ mỹ đã đầu tư 1,2 tỷ USD để phát triển sản phẩm này. Thuốc molnupiravir là loại thuốc ức chế các ribonucleoside do đó có khả năng ngăn chặn sự nhân lên của virus. Kết quả nghiên cứu trên Chồn đã chứng minh thuốc có tác dụng ức chế qua trình nhân lên của virus SARS-CoV-2 là tiền đề để phát triển trên các thử nghiệm lâm sàng.[21]
4.3. Liệu pháp điều hòa miễn dịch
Virus SARS-CoV-2 kích hoạt các phản ứng miễn dịch và có thể gây ra hiện tượng đáp ứng miễn dịch quá mức hay còn gọi là bão cytokine. Do đó việc sử dụng các chất điều hòa miễn dịch để ức chế phản ứng viêm quá mức là một liệu pháp để hỗ trợ điều trị Covid-19. Dexamethasone là một corticosteroid được dụng để chống viêm nhờ tác dụng làm giảm viêm và ức chế miễn dịch. Kết quả một thử nghiệm lâm sàng phục hồi cho thấy, dexanmethasone giảm tỷ lệ tử vong 1/3 đối với bệnh nhân phải thở máy và 1/5 với bệnh nhân phải cung cấp oxy. Tuy nhiên, tác dụng của thuốc với bệnh nhân không phải hỗ trợ hô hấp là không đáng kể.[22] Tocilizumab và sarilumab là hai kháng thể đặc hiệu với thụ thể của interleukin-6 (IL-6) được sử dụng để điều trị các bệnh liên quan đến viêm khớp và hội chứng giải phóng cytokine. Kết quả một thử nghiệm đã chứng minh tác dụng giảm cơn bão cytokine trên bệnh nhân nhiễm Covid-19 thể nặng.[23] Bevacizumab là một chất chống yếu tố tăng trưởng nội mô mạch máu (VEGF) có khả năng làm giảm phù phổi ở bệnh nhân nhiễm Covid-19 nặng. Eculizumab là một kháng thể đơn dòng có khả năng ức chế protein tiền viêm C5. Kết quả bước đầu cho thấy, kháng thể này có khả năng làm giảm các dấu hiệu viêm và nồng độ protein phản ứng C.[23]
Phản ứng của interferon là một trong những cơ chế miễn dịch bẩm sinh để chống lại sự xâm nhập của virus. Interferon gây ra sự biểu hiện của các gen kích hoạt interferons từ đó có thể làm cản trở quả trình nhân bản của virus. Kết quả nghiên cứu trước đây đã cho thấy, interferon loại 1 là một liệu pháp tiềm năng để điều trị bệnh SARS. Kết quả nghiên cứu in vitro chỉ ra rằng, SARS-CoV-2 còn nhạy cảm với interferon loại 1 hơn SARS-CoV.[24] Điều này cho thấy hiệu quả tiềm năng của interferon loại 1 trong điều trị sớm Covid-19. Các nghiên cứu lâm sàng hiện nay đang được thực hiện ở nhiều nơi trên thế giới để đánh giá hiệu quả của liệu pháp này.[25]
4.4. Phương pháp sử dụng huyết thanh miễn dịch
Việc sử dụng huyết tương của người đã hồi phục là một liệu pháp bổ trợ và đã được thử nghiệm với hiệu quả cải thiện tình trạng lâm sàng cho bệnh nhân Covid-19. FDA đã chấp thuận và hướng dẫn sử dụng huyết tương người khỏi bệnh để điều trị Covid-19 trong trường hợp khẩn cấp. Tuy nhiên, phương pháp này có thể có những tác dụng phụ như hiện tượng nhiễm trùng do kháng thể hoặc các phản ứng dị ứng do truyền máu.[26]
Liệu pháp kháng thể đơn dòng là một liệu pháp miễn dịch hiểu quả để điều trị một số bệnh nhiễm virus. Một số nghiên cứu gần đây đã chứng minh kháng thể đơn dòng có thể vô hiệu hóa SARS-CoV-2 trong ống nghiệm và in vivo.[27] So với phương pháp sử dụng huyết thanh của bệnh nhân đã khỏi bệnh, phương pháp kháng thể đơn dòng có thể sản xuất với số lượng lớn để đáp ứng các thử nghiệm lâm sàng. Do đó đây có thể là một liệu pháp khả quan trong việc điều trị Covid-19. Tuy nhiên, giá thành, năng lực sản xuất và sinh khả dụng của kháng thể đơn dòng là trở ngại trong việc phát triển liệu pháp này.[1]

Hình 3. Tổng hợp các liệu pháp điều trị Covid-19[1]
5. Sử dụng các hợp chất tự nhiên trong điều trị Covid-19
Trong khi các liệu pháp y học đang trong giai đoạn thử nghiệm để đánh giá hiệu quả điều trị Covid-19. Các nhà khoa học đang dành nhiều sự quan tâm đến việc sử dụng các hợp chất từ thiên nhiên trong phòng và điều trị covid-19. Việc nghiên cứu và ứng dụng các bài thuốc dân gian, các loại dược liệu, hợp chất thiên nhiên trong điều trị các bệnh liên quan đến virus đã được thực hiện từ lâu và có nhiều bài thuốc, dược liệu được ứng dụng. Việc nghiên cứu và sử dụng dược liệu và các hợp chất tự nhiên sẽ tạo ra liệu pháp an toàn hơn trong phòng và điều trị Covid-19. Nghiên cứu và phát triển các liệu pháp từ thiên nhiên cũng dựa trên tác dụng của các hợp chất/dược liệu đến quá trình xâm nhập, phân chia và nhân lên của virus trong tế bào.
5.1. Hợp chất tự nhiên ức chế quá trình xâm nhập virus vào tế bào
Hypocrellin A và shiraiachrome A là hai perylenequinones chiết xuất từ loài nấm Hypocrella bambusae đã được chứng minh có khả năng ức chế hoạt động của protein S trong SARS-CoV-2 với EC50 là 0,22 µM trên mô hình tế bào Vero E6.[28] Platycodin D, một loại triterpenoid saponin tách chiết từ cây Cát cánh (Platycodon grandiflorum) ức chế hoạt động của TMPRSS2 giúp ngăn cản quá trình liên kết giữa protein S của virus với ACE2 do đó ngăn ngừa sự tiếp hợp của màng tế bào với virus.[29] Resveratrol, một loại phytoalexin, có khả năng ức chế sự phân chia protein S của virus trên mô hình tế bào Vero E6 với EC50 là 4,48µM. Đây có thể coi là một giải pháp tiềm năng do resveratrol là chất an toàn và không có độc tính.[30] Trong một nghiên cứu khảo sát 40 loại dược liệu của Trung Quốc dựa trên dữ liệu khoa học tổng hợp về thành phần chính và các ứng dụng đã có của các dược liệu trên, nhóm nghiên cứu đã đánh giá khả năng tương tác của các hoạt chất trong dược liệu với ACE2 và 3CLpro của SARS-CoV-2 bằng phương pháp mô phỏng in silico. Kết quả chỉ ra các loại dược liệu như Cam Thảo, Hoàng Cầm, Địa Hoàng có ái lực mạnh nhất với ACE2 và 3CLpro. Kết quả này là thông tin quan trọng để tiến hành các nghiên cứu in vitro và in vivo khảo sát tác dụng kháng SARS-CoV-2 của các loại dược liệu trên.[31]
Andrographolide là hoạt chất trong cây Xuyên tâm liên. Kết quả nghiên cứu bằng mô phỏng (in silico) cho thấy hợp chất này có khẳ năng liên kết với protein S trên màng tế bào virus SARS-CoV-2. Kết quả này cung cấp thông tin quan trọng cho các nghiên cứu tiếp theo trên các mô hình thực nghiệm đối với hoạt chất này.[32] Các hợp chất catechin như epicatechin, epigallocatechin gallate trong chè xanh có ái lực mạnh với protein S trên lớp màng virus do đó có thể hạn chế sự xâm nhập của virus vào tế bào.[33] Nghiên cứu mô phỏng in silico khảo sát các flavonoid cho thấy isolilybin và legalon có khả năng liên kết với protein S của virus do đó có tiềm năng là chất ức chế sự xâm nhập của virus vào tế bào.[34] Adhatodine và anisotine trong cây Xuân tiết (Cang mai) có tiềm năng ức chế sự xâm nhập của virus do hợp chất này có ái lực với protein S của virus.[35]
Một số hợp chất polyphenol có khả năng chống virus như mangiferin trong cây xoài, phlorizin trong cây táo, glucogallin trong quả me rừng được sử dụng để đánh giá khả năng khắng virus SARS-CoV-2 thông qua khẳ năng ức chế TMPRSS2 của virus. Kết quả cho thấy, cả ba hợp chất phenol đều có ái lực mạnh với TMPRSS2 tương tự như thuốc Camosstat mesylate và có ái lực với 3CLpro tường đồng với Remdesivir.[36]
5.2. Các hợp chất tự nhiên ức chế quá trình phân chia và nhân lên của virus
Corilagin là một loại gallotannin được chiết xuất từ cây Diệp hạ châu có khẳ năng ngăn ngừa quá trình hình thành enzyme sao chép virus RNA-dependent RNA polymerase (RdRp) với EC50 là 0,13µM.[37] Baicalein trong cây Hoàng cầm cũng được chứng minh có khả năng ức chế sự nhân lên của virus thông qua quá trình ức chế enzyme RdRp[38]. Dịch chiết ethanol và baicalein có khẳ năng ức chế hoạt tính của 3CLpro trên mô hình tế bào với IC50 lần lượt là 8,52 µg/ml và 0,39 µM.[39] Nghiên cứu in vitro chỉ ra rằng baicalein giúp ngăn ngừa sự tổn thương của tế bào do Sars-CoV-2 gây ra trên mô hình tế bào Vero E6 ở nồng độ 0,1 µM. Trên mô hình chuột nhiễm SARS-CoV-2, bacailein giúp làm giảm tốc độ nhân lên của virus, cải thiện chức năng phổi, giảm các biểu hiện viêm trên phổi và giảm hàm lượng IL-1β và TNF-α.[40] Do đó Hoàng cầm có thể được xem là một loại dược liệu có tiềm năng trong phòng và điều trị Covid-19.
Nghiên cứu sử dụng mô phỏng tương tác (in silico) để đánh giá tác dụng của các hợp chất polyphenol (quercetin, naringenin, caffeine, oleuropein, ellagic acid, benzoic acid, resveratrol, gallic acid) ức chế hoạt động của enzyme tham gia vào quá trình nhân lên của SARS-CoV-2 (RdRp). Kết quả cho thấy, quercetin and gallic acid có ái lực mạnh nhất với RdRp. Đây là thông tin quan trọng để tiếp tục có các nghiên cứu in vitro và in vivo của hai hợp chất này.[41] Nghiên cứu mô phỏng đánh giá tương tác giữa các hợp chất trong Xuyên tâm liên và Diệp hạ châu đối với protein S và các enzymes tham gia vào quá trình nhân lên của virus như 3CLpro, PLpro, RdRp của SARS-CoV-2 cho thấy, các flavonoids (astragalin, kaempferol, quercetin, quercetin-3-O-glucoside and quercetin) và tannins (corilagin, furosin and geraniin) trong cây Diệp hạ châu có ái lực mạnh với S protein, 3CLpro, PLpro, và RdRp trong khi các hợp chất terpenoid (isoandrographolide, 14-deoxy-14,15-di-dehydroandrographolide, 14-deoxyandrographolide, 19-O-acetyl-14-deoxy-11,12-didehydroandrographolide, và neoandrographolide) trong cây Xuyên tâm liên có ái lực mạnh với S protein và enzyme RdRp.[42] Kết quả này tạo tiền đề cho các nghiên cứu in vitro và in vivo để đánh giá hoạt tính kháng virus của hợp chất này.[43]
Flavonoid là nhóm chất tự nhiên có nhiều hoạt tính sinh học. Nghiên cứu sử dụng mô phỏng dự đoán tương tác giữa các flavonoid với các protease RdRp và protein S. Kết quả lựa chọn được 5 hợp chất gồm: Albireodelphin, Apigenin 7-(6’’-malonylglucoside), Cyanidin-3-(p-coumaroyl)-rutinoside-5-glucoside, Delphinidin 3-O-beta-D-glucoside 5-O-(6- coumaroyl-beta-D-glucoside) và (-)-Maackiain-3-O-glucosyl-6’’-O-malonate có khẳ năng ức chế enzyme RdRp và protein S của SARS-CoV-2. Kết quả này là thông tin quan trọng cho các nghiên cứu tiếp theo về hoạt tính kháng virus SARS-CoV-2 của các hợp chất trên.[44]
5.3. Các hợp chất tự nhiên trong điều hòa hệ miễn dịch
Glycyrrhizic acid, quercetin, baicalein, naringenin, wogonin là các hợp chất chính trong một số bài thuốc hỗ trợ điều trị Covid-19 tại Trung Quốc. Các hợp chất này có tác dụng điều hòa hệ miễn dịch thông qua tác dụng khóa thụ thể toll-like và ức chế sự tạo thành IL-6, một trong những yếu tố tạo thành hiện tượng bão cytokine của bệnh nhân Covid-19.[45] Sử dụng kỹ thuật mô phỏng chỉ ra rằng andrographolide trong cây Xuyên tâm liên có khả năng ức chế yếu tố hạt nhân tăng cường chuỗi nhẹ kappa B1 (NFκB1), yếu tố hoại tử khối u (TNF) và khóa các đường hướng phát sinh bão cytokine như quá trình tạo thành IL-6.[46]
6. Kết luận
Đại dịch Covid-19 đang diễn ra rất phức tạp do sự phát sinh nhiều biến thể mới của virus SARS-CoV-2. Mặc dù một số vaccine đã được nghiên cứu, phát triển và được sử dụng có hiệu quả. Tuy nhiên Việc phát triển các liệu pháp phòng tránh và điều trị Covid-19 cần phải được quan tâm nhiều hơn nữa. Dựa trên cơ chế xâm nhập, nhân lên và phát tán của virus, quá trình nghiên cứu phát triển các liệu pháp cần tập trung vào việc ngăn cản sự tiếp hợp (xâm nhập) của virus vào tế bào thông qua ức chế, khóa protein S, enzyme protease xuyên màng serine 2 (TMPRSS2), catheepsin L, và furin. Mặt khác, để ngăn cản sự nhân lên của virus trong tế bào, cần phát triển các sản phẩm ức chế enzyme tham gia vào quá trình nhân lên của tế bào như 3C-like protease (3CLpro), RNA-dependent RNA polymerase (RdRp). Ngoài ra, các hợp chất giúp điều hòa hệ miễn dịch, kháng viêm cũng có thể sử dụng để tránh hiện tượng bão cytokine xảy ra do đáp ứng miễn dịch quá mức của tế bào.
Hiện nay, nhiều nghiên cứu lâm sàng đang tiến hành để đánh giá toàn diện tác dụng của các loại thuốc đã được sử dụng trước đó để chống virus SARS, MERS, cúm, thuốc kháng viêm. Tuy nhiên chưa có thuốc nào đạt được hiệu quả và độ an toàn để đưa ra sử dụng rộng rãi trên thế giới. Việc sử dụng các loại dược liệu, hợp chất tự nhiên trong hỗ trợ và điều trị Covid-19 cũng đang đươc nghiên cứu dựa trên các kinh nghiệm dân gian. Tuy nhiên các nghiên cứu này mới chỉ dừng lại ở nghiên cứu mô phỏng (in silico). Các kết quả nghiên cứu mô phỏng ban đầu sẽ cung cấp các thông tin hữu ích cho việc xây dựng các nghiên cứu in vitro, in vivo và nghiên cứu lâm sàng để phát triển các sản phẩm hộ trợ và điều trị Covid-19 từ thiên nhiên.
Tài liệu tham khảo
[1] Hu B, Guo H, Zhou P, et al. Characteristics of SARS-CoV-2 and COVID-19. Nat Rev Microbiol [Internet]. 2021;19:141–154. Available from: http://dx.doi.org/10.1038/s41579-020-00459-7.
[2] Glycoprotein C-S, Walls AC, Park Y, et al. Structure , Function , and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell [Internet]. 2020;181:281-292.e6. Available from: http://dx.doi.org/10.1016/j.cell.2020.02.058.
[3] Chakravarti R, Singh R, Ghosh A, et al. A review on potential of natural products in the management of COVID-19. RSC Adv. 2021;11:16711–16735.
[4] Shirbhate E, Pandey J, Patel VK, et al. Understanding the role of ACE-2 receptor in pathogenesis of COVID-19 disease: a potential approach for therapeutic intervention. Pharmacol Reports [Internet]. 2021;27:1–12. Available from: https://doi.org/10.1007/s43440-021-00303-6.
[5] Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181:271-280.e8.
[6] V’kovski P, Kratzel A, Steiner S, et al. Coronavirus biology and replication: implications for SARS-CoV-2. Nat Rev Microbiol [Internet]. 2021;19:155–170. Available from: http://dx.doi.org/10.1038/s41579-020-00468-6.
[7] Wang X, Cao R, Zhang H, et al. The anti-influenza virus drug, arbidol is an efficient inhibitor of SARS-CoV-2 in vitro. Cell Discov. 2020;6:1–5.
[8] Zhu Z, Lu Z, Xu T, et al. Arbidol monotherapy is superior to lopinavir / ritonavir in treating COVID-19. J Infect. 2020;81:e21–e23.
[9] Li Y, Xie Z, Lin W, et al. Efficacy and Safety of Lopinavir/Ritonavir or Arbidol in Adult Patients with Mild/Moderate COVID-19: An Exploratory Randomized Controlled Trial. Med [Internet]. 2020;1:105-113.e4. Available from: https://doi.org/10.1016/j.medj.2020.04.001.
[10] Lian N, Xie H, Lin S, et al. Umifenovir treatment is not associated with improved outcomes in patients with coronavirus disease 2019 : a retrospective study. Clin Microbiol Infect. 2020;26:917–921.
[11] Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020;30:269–271.
[12] Yao X, Ye F, Zhang M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Clin Infect Dis. 2020;71:732–739.
[13] Geleris J, Sun Y, Platt J, et al. Observational Study of Hydroxychloroquine in Hospitalized Patients with Covid-19. N Engl J Med. 2020;382:2411–2418.
[14] Rosenberg ES, Dufort EM, Udo T, et al. Association of Treatment with Hydroxychloroquine or Azithromycin with In-Hospital Mortality in Patients with COVID-19 in New York State. JAMA - J Am Med Assoc. 2020;323:2493–2502.
[15] Monteil V, Kwon H, Prado P, et al. Inhibition of SARS-CoV-2 Infections in Engineered Human Tissues Using Clinical-Grade Soluble Human ACE2. Cell. 2020;181:905-913.e7.
[16] Williamson BN, Feldmann F, Schwarz B, et al. Clinical benefit of remdesivir in rhesus macaques infected with SARS-CoV-2. Nature [Internet]. 2020;585:273–276. Available from: http://dx.doi.org/10.1038/s41586-020-2423-5.
[17] Grein J, Ohmagari N, Shin D, et al. Compassionate Use of Remdesivir for Patients with Severe Covid-19. N Engl J Med. 2020;382:2327–2336.
[18] Beigel JH, Tomashek KM, Dodd LE, et al. Remdesivir for the Treatment of Covid-19 — Final Report. N Engl J Med. 2020;383:1813–1826.
[19] Cai Q, Yang M, Liu D, Chen J, Shu D, Xia J, Liao X, Gu Y, Cai Q, Yang Y, Shen C, Li X, Peng L, Huang D, Zhang J, Zhang S, Wang F, Liu J, Chen L, Chen S, Wang Z, Zhang Z, Cao R, Zhong W, Liu Y LL. Experimental Treatment with Favipiravir for COVID-19: An Open-Label Control Study. Engineering [Internet]. 2020;6:1192–119818. Available from: https://www.journalofinfection.com/article/S0163-4453(20)30116-X/fulltext.
[20] Gagliardini R, Cozzi-Lepri A, Mariano A, et al. No Efficacy of the Combination of Lopinavir/Ritonavir Plus Hydroxychloroquine Versus Standard of Care in Patients Hospitalized With COVID-19: A Non-Randomized Comparison. Front Pharmacol. 2021;12:1–12.
[21] Cox RM, Wolf JD, Plemper RK. Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV-2 transmission in ferrets. Nat Microbiol [Internet]. 2021;6:11–18. Available from: http://dx.doi.org/10.1038/s41564-020-00835-2.
[22] Group RC. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021;384:693–704.
[23] Patel B, Sharma S, Nair N, et al. Therapeutic opportunities of edible antiviral plants for COVID-19. Mol Cell Biochem [Internet]. 2021;476:2345–2364. Available from: https://doi.org/10.1007/s11010-021-04084-7.
[24] Mantlo E, Bukreyeva N, Maruyama J, et al. Antiviral activities of type I interferons to SARS-CoV-2 infection. Antiviral Res. 2020;179:104811.
[25] Park A, Iwasaki A. Type I and Type III Interferons – Induction, Signaling, Evasion, and Application to Combat COVID-19. Cell Host Microbe [Internet]. 2020;27:870–878. Available from: https://doi.org/10.1016/j.chom.2020.05.008.
[26] Duan K, Liu B, Li C, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci U S A. 2020;117:9490–9496.
[27] Wang C, Li W, Drabek D, et al. A human monoclonal antibody blocking SARS-CoV-2 infection. Nat Commun [Internet]. 2020;11:1–6. Available from: http://dx.doi.org/10.1038/s41467-020-16256-y.
[28] Yang L, Zhonglei W. Natural Products , Alone or in Combination with FDA-Approved Drugs, to Treat COVID-19 and Lung Cancer. Biomedicines. 2021;9.
[29] Kim TY, Jeon S, Jang Y, et al. Platycodin D, a natural component of Platycodon grandiflorum, prevents both lysosome- and TMPRSS2-driven SARS-CoV-2 infection by hindering membrane fusion. Exp Mol Med [Internet]. 2021;53:956–972. Available from: http://dx.doi.org/10.1038/s12276-021-00624-9.
[30] Yang M, Wei J, Huang T, et al. Resveratrol inhibits the replication of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in cultured Vero cells. Phyther Res. 2021;35:1127–1129.
[31] Ren X, Shao X, Li X, et al. Identifying potential treatments of COVID-19 from Traditional Chinese Medicine (TCM) by using a data-driven approach. J Ethnopharmacol. 2020;258:112932.
[32] Srikanth L, Venkata P, Krishna G. Andrographolide binds to spike glycoprotein and RNA-dependent RNA polymerase ( NSP12 ) of SARS-CoV-2 by in silico approach : a probable molecule in the development of anti-coronaviral drug. J Genet Eng Biotechnol. 2021;19.
[33] Anand AV, Balamuralikrishnan B, Kaviya M, et al. Medicinal plants, phytochemicals, and herbs to combat viral pathogens including sars-cov-2. Molecules. 2021;26.
[34] Mishra GP, Bhadane RN, Panigrahi D, et al. The interaction of the bioflavonoids with five SARS-CoV-2 proteins targets: An in silico study. Comput Biol Med. 2021;134:104464.
[35] Omokhua-uyi AG, Staden J Van. Natural product remedies for COVID-19: A focus on safety. South African J Bot. 2021;139:386–398.
[36] Singh R, Gautam A, Chandel S, et al. Protease Inhibitory Effect of Natural Polyphenolic Compounds on SARS-CoV-2: An In Silico Study. Molecules. 2020;25.
[37] Li Q, Yi D, Lei X, et al. Corilagin inhibits SARS-CoV-2 replication by targeting viral RNA-dependent RNA polymerase. Acta Pharm Sin B [Internet]. 2021;11:1555–1567. Available from: https://doi.org/10.1016/j.apsb.2021.02.011.
[38] Polymerase R, Zandi K, Musall K, et al. Baicalein and Baicalin Inhibit SARS-CoV-2. Microorganisms [Internet]. 2021;9:1–10. Available from: https://doi.org/ 10.3390/microorganisms9050893.
[39] Liu H, Ye F, Sun Q, et al. Scutellaria baicalensis extract and baicalein inhibit replication of SARS-CoV-2 and its 3C-like protease in vitro. J Enzyme Inhib Med Chem [Internet]. 2021;36:497–503. Available from: https://doi.org/10.1080/14756366.2021.1873977.
[40] Song J, Zhang L, Xu Y, et al. The comprehensive study on the therapeutic effects of baicalein for the treatment of COVID-19 in vivo and in vitro. Biochem Pharmacol. 2021;183.
[41] Huang J, Tao G, Liu J, et al. Current Prevention of COVID-19: Natural Products and Herbal Medicine. Front Pharmacol. 2020;11:1–18.
[42] Hiremath S, Kumar HDV, Nandan M, et al. In silico docking analysis revealed the potential of phytochemicals present in Phyllanthus amarus and Andrographis paniculata, used in Ayurveda medicine in inhibiting SARS-CoV-2. 3 Biotech [Internet]. 2021;11:1–18. Available from: https://doi.org/10.1007/s13205-020-02578-7.
[43] Murugan NA, Pandian CJ, Jeyakanthan J. Computational investigation on Andrographis paniculata phytochemicals to evaluate their potency against SARS-CoV-2 in comparison to known antiviral compounds in drug trials. J Biomol Struct Dyn [Internet]. 2020;0:1–12. Available from: https://doi.org/10.1080/07391102.2020.1777901.
[44] Rameshkumar MR, Indu P, Arunagirinathan N, et al. Computational selection of flavonoid compounds as inhibitors against SARS-CoV-2 main protease, RNA-dependent RNA polymerase and spike proteins: A molecular docking study. Saudi J Biol Sci [Internet]. 2021;28:448–458. Available from: https://doi.org/10.1016/j.sjbs.2020.10.028.
[45] Huang Y, Bai C, He F, et al. Review on the potential action mechanisms of Chinese medicines in treating Coronavirus Disease 2019 (COVID-19). Pharmacol Res. 2020;158:104939.
[46] Rehan M, Ahmed F, Howladar SM, et al. A Computational Approach Identified Andrographolide as a Potential Drug for Suppressing COVID-19-Induced Cytokine Storm. Front Immunol. 2021;12:1–10.